La Sarna plateada es una enfermedad del cultivo de papa que afecta fuertemente a los tubérculos de papa, pero no al resto de la planta. Esta patología produce pérdidas importantes en la calidad del tubérculo debido a la decoloración del peridermo y a la pérdida de turgencia por deshidratación. La infección puede resultar en el 100% de la superficie del tubérculo afectada y en la reducción del peso de las papas de 5-7 % a causa de la pérdida de agua. La Sarna plateada ha ido en aumento en los últimos años debido al uso de tubérculo semilla de papa (TSP) con la enfermedad, rotaciones cortas e infraestructura de almacenamiento no adecuada.
Agente Causal
El agente causal de Sarna plateada es el hongo Helminthosporium solani (Dur. & Mont). Este hongo desarrolla micelio septado, ramificado y hialino, que se torna café verdoso con la edad y los conidióforos no son ramificados. La conidia tiene más de 8 septas que son de color café oscuras (Foto 1). El patógeno es de lento crecimiento y de reproducción asexual y esporula en tubérculos infectados bajo altas condiciones de humedad.
Sintomatología

Foto 1. Las conidias y conidióforos que desarrolla el hongo en la superficie del tubérculo en almacenamiento, aumenta el inóculo ambiental y produce nuevas infecciones y lesiones. Fuente: INIA Remehue.
La sintomatología principal de la enfermedad se observa solo en los tubérculos, como manchas de color pardo claro y de aspecto brillante. El color plateado de los tubérculos se debe a la perdida de pigmentos a causa de la degradación de las células y la deposición de suberinas en la pared celular. Estas manchas se visualizan de mejor forma cuando el tubérculo se encuentra húmedo.
En un principio los síntomas son pequeños puntos circulares de color castaño claro, con márgenes indefinidos, que se agrandan hasta cubrir gran parte del tubérculo dando un aspecto de plateado (Foto 2). Muchas veces estas manchas pueden estar presentes al momento de la cosecha y ser imperceptibles a simple vista. Durante el almacenaje, debido a la humedad que se pueda presentar, el hongo en la superficie del tubérculo desarrolla sus conidióforos y conidias que son de un color verde oliva y dan en el tubérculo una apariencia de manchas plateadas (Foto 1). Estas manchas, luego, provocan una deshidratación que hacen que el tejido afectado se hunda y arrugue, y la epidermis se recoge y levante formando escamas y costras.

Foto 2. Lesiones de Sarna plateada en tubérculos de papa. Se observan manchas de color pardo claro y de aspecto brillante. Fuente: INIA Remehue.
EPIDEMIOLOGÍA Y CICLO BIOLÓGICO
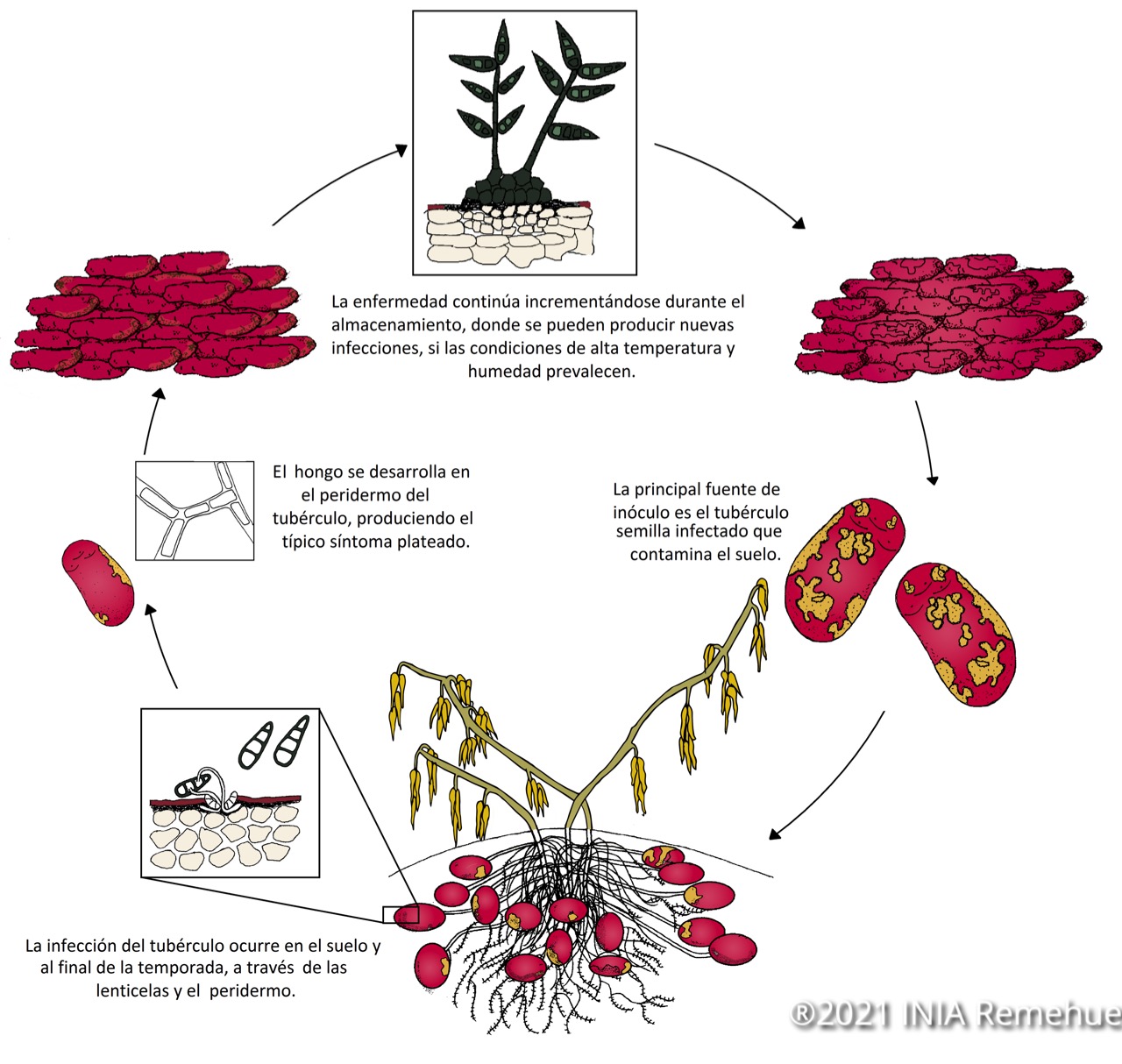
Ilustración 1. Ciclo de la Sarna plateada (Helminthosporium solani) Fuente: INIA Remehue.
La transmisión del hongo es principalmente a través de tubérculo semilla enfermo que infecta el suelo. La infección del tubérculo ocurre en el suelo a través de las lenticelas y el peridermo al final de la temporada. Cuanto más permanecen los tubérculos maduros en el suelo, mayor es la probabilidad de infección y severidad de la enfermedad. La enfermedad continúa incrementándose durante el almacenamiento, donde se pueden producir nuevas infecciones si las condiciones de temperatura y humedad favorecen la formación de agua libre sobre los tubérculos.
Las condiciones mínimas para la infección son temperatura de 3°C y 90% de humedad relativa, condiciones que estimulan la germinación de los conidios. La esporulación es más abundante en las lesiones viejas, incrementándose el potencial de diseminación del inóculo y produciendo nuevas infecciones.
El hongo tiene una breve permanencia en el suelo pero puede sobrevivir en residuos vegetales o plantas voluntarias, y propagarse con rapidez cuando existen residuos con una relación carbono: nitrógeno alta.
La enfermedad prolifera principalmente en almacenamiento por la dispersión de conidios que se producen en las lesiones de los tubérculos al presentarse condiciones favorables. Estos conidios son transmitidos por contacto directo entre los tubérculos o por el movimiento de aire en la bodega, esto último favorece la dispersión a otros tubérculos alejados. Una vez que el hongo penetra el tubérculo, el micelio se expande dentro de las células y se producen nuevos conidios, aumentando la infección. En la bodega los conidios pueden sobrevivir en residuos vegetales o polvo y ser capaces de infectar los tubérculos al año siguiente.
PLAN DE CONTROL INTEGRADO
El control de esta enfermedad debe ser integrado, esto significa utilizar un sistema que considere todas las alternativas posibles para controlar o erradicar la enfermedad, ya que una sola medida no es suficiente para obtener un buen control. Además, se debe tratar de buscar opciones de bajo costo y compatibles con el medio ambiente. Entre estas alternativas se encuentran:
- Identificar correctamente el problema mediante el diagnóstico de la enfermedad, esto ayuda a tomar mejores decisiones para minimizar la incidencia y severidad de la enfermedad detectada.
- Uso de semilla legal, que asegura la pureza varietal y garantiza el cumplimiento de las tolerancias sanitarias y un tubérculo semilla de alta sanidad, disminuyendo, por lo tanto, el riesgo de la presencia de la enfermedad. Se debe considerar que el tubérculo semilla es la principal fuente de inóculo de la sarna plateada.
- Rotación de cultivos adecuada, considerando rotaciones de 3 o más años, utilizando cultivos no susceptibles a la enfermedad. A pesar de que el hongo tiene una breve permanencia en suelo; puede vivir en residuos vegetales o plantas voluntarias, y propagarse con rapidez alcanzando en las nuevas plantaciones.
- Cosecha oportuna, cosechando tubérculos maduros, y evitando una permanencia muy prolongada en el suelo post desecado, ya que esto favorece la infección del hongo.
- Tratamiento químico a la plantación a la semilla o al suelo ha demostrado tener una eficacia baja a media para el control de la sarna plateada. También se puede considerar una aplicación a la semilla al ingresar a la bodega, sin embargo, es de gran relevancia el método de aplicación, ya que el aplicar humedad sobre los tubérculos favorece la inducción de pudriciones blandas en bodega. Algunos ingredientes activos registrados son: Fludioxonilo, Thiabendazole, Carbendazima, Penflufen, entre otros. Se debe siempre aplicar productos registrados para el cultivo de papa.
- Almacenamiento adecuado, considerando higiene y adecuado manejo durante el almacenamiento logran la prevención de la dispersión del hongo y las nuevas infecciones. Después de la cosecha, los tubérculos deben ingresar secos y permanecer alrededor de 15 días bajo condiciones de 13°C y 90% de humedad relativa para favorecer la cicatrización de heridas y golpes que sufrieron durante la cosecha. Después de estos 15 días, el almacenamiento debería realizarse a temperaturas óptimas entre 3°C a 10°C y una humedad relativa de 90 a 95%. Es relevante evitar la condensación de agua sobre los tubérculos, mediante el manejo adecuado de la temperatura y la ventilación. El agua libre favorece las condiciones para a esporulación del hongo.
BIBLIOGRAFÍA
Acuña, I y Cadiz, F. 2011. Principales enfermedades de la papa en el almacenamiento y su manejo. Informativo N° 83. Instituto de Investigaciones Agropecuarias (INIA). https://biblioteca.inia.cl/handle/123456789/4736
Acuña, I y Cadiz, F. 2011. Desinfección de tubérculo semilla de papa y sus consideraciones. Informativo N° 84. Instituto de Investigaciones Agropecuarias (INIA). https://biblioteca.inia.cl/handle/123456789/4737
Acuña, I.; Muñoz, M.; Sandaña, P.; Orena,S.; Bravo, R.; Kalazich, J.; Tejeda, P.; Castro M.P. y C. Sandoval. 2015. Manual Interactivo de la papa INIA. Instituto de Investigaciones Agropecuarias (INIA). Chile. http://manualinia.papachile.cl
Frazier, M.; Shetty, K.; Kleinkopf, G.; Nolte P. 1998. Management of silver scurf (Helminthosporium solani) with fungicide seed treatments and storage practices. Am. J. Potato Res. 75:129-135.
Adams, AP.; Sandar, N; Nelson, DC. 1970. Some properties of soils affecting russet scab and silver scurf of potatoes. American Potato Journal 47:49-57.
Barnett, H.; Hunter, B. 1998. Helminthosporium. In: “Illustrated Genera of Imperfect Fungi”; H.L. Barnett; B.B. Hunter eds.; 4 ed. St Paul, Minnesota, American Phytopathological Society Press. 124 p.
Cottle, W.; Kolattukudy, P. 1982. Biosynthesis, deposition, and partial characterization of potato suberin phenolics. Plant Physiology 69:393-399.
Fireman, D.; Allen, E. 1995. Transmission of Helminthosporium solani from potato seed tubers and effects of soil conditions, seed inoculum and seed physiology on silver scurf disease. J. Agric. Science, Cambridge 124:219-234. (Mims 1991).
Hardy, C.; Burgess, P.; Pringle, R. 1997. The effect of condensation on the sporulation of Helminthosporium solani on potato tubers infected with silver scurf and held in simulated store conditions. Potato Research 40:169-180.
Heiny, D.; McIntyre, A. 1983. Helminthosporium solani dur. y mont. development on potato periderm. American Potato Journal 60:773-789.
Hide, G.; Adams, M. 1980. Relationship between disease levels on seed tubers, on crops during growth and in stored potatoes 3. Silver scurf. Potato Res. 23:229-240.
Hunger, R.; McIntyre, A. 1979. Occurrence, development, and losses associated with silver scurf and black dot on Colorado potatoes. American Potato Journal 56: 289-306.
Jellis, G.; Taylor, G. 1977. The development of silver scurf (Helminthosporium solani) disease of potato. Annals of Applied Biology 86:19-28.
Kamara, A.; Huguelet, J. 1972. Host range and overwintering of Helminthosporium solani. (Abstr.) American Potato Journal 49:365.
Kurzkawínska, H. 2006. An interaction of potato crop soil fungi population on fungi responsible for potato tuber superficial diseases. J. Plant Prot. Research 46(4):339- 346.
Martínez, C.; Rioux, D.; Tweddell, R. 2004. Ultrastructure of the infection process of potato tuber by Helminthosporium solani, causal agent of potato silver scurf. Mycol. Research 108:828-836.
Peters, R. 1999. Einfluss des Erntetermins und der Lagerung auf den Silberschorfbefall. Mitt. der Dt. Phytomedizin. Gesellschaft 29(2):27.
Pringle, R.; Hardy, C.; Clayton, R.; McGovern, R.; Potter, K. 1998. Chemical free storage of potatoes. Scottish Agriculture College Information Bulletin. Aberdeen, Inglaterra: SAC 1-3.
Radtke, W.; Rieckmann, W.; Brendler, F. 2000. Kartoffel – Krankheiten, Schädlinge, Unkräuter. Verlag Th. Mann, Gelsenkirchen-Buer Alemania 272 p
Soliday, C.; Kolattukudy, P.; Davis, R. 1979. Chemical and ultrastructural evidence that waxes associated with the suberin polymer constitute the major diffusion barrier to water vapor in potato tuber (Solanum tuberosum). Planta 146:607-614.
Stevenson, C.; Loría, R.; Franc, D.; Weingartner, D. 2001. Compendium of potato diseases. 2 ed. Americ. Phytopath. Society Press, St. Paul, MN, Estados Unidos. 106 p.
EVALUACIÓN DE RIESGO
Te invitamos a probar nuestra plataforma, y evaluar cuales son los riesgos de tu producción.
Autorizada la reproducción total o parcial citando la fuente y autores.
Cita Bibliográfica
Acuña, I.; Sandoval, C. y Sepúlveda, C. 2021. Enfermedades de la papa: Plataforma de evaluación de riesgo sanitario. Instituto de Investigaciones Agropecuarias INIA, Chile. https://enfermedadespapa.inia.cl.
Los contenidos de esta plataforma están bajo registro de propiedad intelectual en el Servicio Nacional de Patrimonio Cultural, Departamento de Derechos Intelectuales (DDI), con el código 2022-A-6499


